(vahva happo)
(vahva happo)
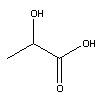
(laktaatti-ioni)
(betahydroksibutyraatti, vahva happo)
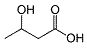
(heikko happo)
NH4+ < -> NH3 + H+
(hiilidioksidin vesiliuos, heikko happo)
H2CO3
Harva laboratoriotutkimus on periaatteiltaan niin monimutkainen ja ristiriitaisesti selitetty kuin happoemästaseeseen liittyvät tutkimukset. Tässä dokumentissa kuvataan eri selitysmallit ilman monimutkaista matematiikkaa ja havainnollistetaan kvantitatiivista tulkintaa todellisilla potilasesimerkeillä.
Happoemästaseen ymmärtämiseksi on välttämätöntä ymmärtää veden rakenne. Vesi koostuu kahdesta vetyatomista ja yhdestä happiatomista. Vedellä on taipumus hajota (dissosioitua) siten, että yksi vetyatomeista lähtee omille teilleen ja jättää ainoan elektroninsa happiatomille. Näin syntyy vetyioni (toiselta nimeltään protoni) ja hydroksyyli-ioni.
Veden rakenteesta johtuen vetyionit hakeutuvat lähelle vapaata elektroniparia joka löytyy jokaisesta happiatomista. Näin syntyy mm. hydroniumioneja
Vetyinonit voivat assosioitua myös muihin kohteisiin, joista löytyy sopiva elektronipari. Esim. proteiinien aminoryhmät ovat riittävän elektronegatiivisia joten proteiinien varaus vesiliuoksissa on riippuvainen veytyionikonsentraatiosta. Tällä on suuri merkitys biologisissa prosesseissa.
Yllä kuvatut protonoitumisreaktiot ovat tasapainoreaktioita. Reaktioon osallistuvien komponenttien suhteellisia osuuksia voidaan kuvata tasapainovakion avulla. Esim. veden dissosiaatiota voidaan kuvata dissosiaatiovakiolla Kw:
Veden dissosiaatiovakio on vain n. 4,3 x 10-16 mol/l 37°C lämpötilassa. Näin ollen veden konsentraatiota voidaan pitää vakiona jolloin saadaan seuraava tasapainoyhtälö:
Ylläoleva kaava voidaan tulkita seuraavasti:
Vaikka vetyionien pitoisuudet ovat nanomolaarisia, on niillä biologisesti suuri vaikutus.
Liuos on neutraali, kun [H+] = [OH-]. Puhtaassa vedessä +25 °C lämpötilassa [H+] = 10-7 mol/l
Korkeammissa lämpötiloissa vesi pyrkii dissosioitumaan enemmän jolloin liuoksen vetyionikonsentraatio kasvaa.
Jotta vältyttäisiin pienten lukujen käsittelyltä, on otettu käyttöön logaritminen suure pH:
Jos liuoksen [H+] pienenee, pH nousee ja päinvastoin.
Jos pH laskee 7,4 ⇒ 7,0, nousee [H+] 2,5-kertaiseksi
| pH | [H+] mmol/l | |
|---|---|---|
| 7.0 | 1/10 000 000 | 1,000 x 10-7 |
| 7.1 | 1/12 589 254 | 0,794 x 10-7 |
| 7.2 | 1/15 848 931 | 0,631 x 10-7 |
| 7.3 | 1/19 952 623 | 0,501 x 10-7 |
| 7.4 | 1/25 118 864 | 0,398 x 10-7 |
Hapot tuottavat liuokseen vetyionin ja anionin (negatiivisen ionin), kun ne liukenevat veteen.
Emäs puolestaan tuottaa kationin (positiivisen ionin) ja hydroksyyli-ionin.
Ylläoleva tarkoittaa käytännössä sitä, että happoemästase voidaan tulkita analysoimalla liuoksessa olevien positiivisten ja negatiivisten ionien erotusta. Siten esim. ruokasuolan (natriumkloridi) vesiliuos voidaan kuvata yhtälöllä:
Natrium- ja kloridijoneja on yhtä monta kappaletta joten myös vety- ja hydroksyyli-ionien määrät ovat yhtäsuuret. Liuoksen on oltava neutraali.
| Aine | Kaava | Dissosiaatio |
|---|---|---|
| Suolahappo (vahva happo) |
HCl | H+ + Cl- |
| Maitohappo (vahva happo) |
 |
H+ + CH3CH(OH)COO- (laktaatti-ioni) |
| Voihappo (betahydroksibutyraatti, vahva happo) |
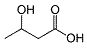 |
H+ +CH3CH(OH)CH2COO- |
| Ammoniumkloridi (heikko happo) |
NH4Cl | NH4+ + Cl- NH4+ < -> NH3 + H+ |
| Hiilihappo (hiilidioksidin vesiliuos, heikko happo) |
H2O + CO2 ⇔ H2CO3 |
H+ + HCO3- |
| Aine | Kaava | Dissosiaatio |
|---|---|---|
| Natriumhydroksidi (vahva emäs) |
NaOH | Na+ + OH- |
| Natriumbikarbonaatti (heikko emäs) |
NaHCO3 | Na+ + HCO3-
HCO3-+ H2O < - > H2CO3 + OH- |
| Natriumasetaatti (heikko emäs) |
CH3COONa | Na+ + CH3COO- CH3COO- + H2O < - > CH3COOH + OH- |
Vahvat hapot ja emäkset dissosioituvat täysin vesiliuoksessa. Jos niitä sekoittaa yhtä suuret määrät saadaan vastaavan suolan vesiliuos, joka on neutraali.
Heikkojen happojen ja vahvojen emästen muodostamien suolojen vesiliuokset ovat emäksisiä (esim. natriumasetaatti ja natriumbikarbonaatti). Tämä johtuu siitä, että syntyvä happoanioni (esim. asetaatti) sitoo vetyioneja ja lisää näin hydroksyyli-ionien määrää.
Otetaan esimerkiksi kolme tyypillistä potilastapausta. Alla kuvatussa taulukossa otetaan huomion yleisimmät plasmassa esiintyvät ionit ja niiden pitoisuudet.
| Ioni | Pitoisuus mmol/l | ||
|---|---|---|---|
| Na+ | 139 | 141 | 137 |
| K+ | 4.1 | 4.6 | 3.3 |
| Cl- | 109 | 111 | 103 |
| Pos -Neg | 34 | 35 | 37 |
Jos vähennetään positiivisten ionien määrästä negatiivinen ioni (kloridi), saadaan nollaa suurempi luku. Jos puuttuva negatiivinen varaus olisi kokonaan hydroksyyli-ioneja, saataisiin vahvasti emäksinen liuos. Oletetaan, että erotus on puhtaasti [OH-] -ioneja, ja sijoitetaan pitoisuus (esim. 35 mmol/l) veden ionitulon kaavaan. Nyt voidaan ratkaista [H+]:
Liuoksen vetyionikonsentraatioksi saadaan 1/35 * 10-11 mol/l eli liuoksen pH on yli 12. Käytännössä tiedetään, että plasman pH on n. 7.4. Mistä näin suuri ero johtuu?
Hiilidioksidi on kaasu, jota muodostuu hiilipitoisten yhdisteiden palaessa. Hiilidioksidi liukenee veteen muodostaen hiilihappoa:
Hiilihapon dissosiaatiotasapaino voidaan kuvata seuraavalla yhtälöllä:
Kaavassa pCO2 on hiilidioksidin osapaine, HCO3- on bikarbonaatti-ioni. Hiilidioksidin osapaine annetaan kirjallisuudessa usein yksikössä mmHg. Se voidaan muuntaa SI-yksikköön kPa jakamalla luvulla 760/101,325 = 7,5.
Hiilidioksidia muodostuu soluhengityksessä ja se eliminoituu keuhkojen kautta. Veressä sitä tarvitaan neutraloimaan vahvojen ionien epätasapainosta johtuva emäsylimäärä. Se ei siis ole tarpeeton metabolian sivutuote vaan merkittävä osatekijä elimistön happoemästaseen säätelyssä.
Veressä on n. 24 mmol/l hiilihapon dissosiaation tuottamaa bikarbonaatti-ionia. Jos tämä otetaan huomioon, on positiivisten ja negatiivisten ionien pitoisuusero enää n. 10 mmol/l. Kun otetaan lisäksi huomioon muut elimistön tuottamat hapot ja niiden anionit (sulfaatti, fosfaatti, hydroksibutyraatti, laktaatti ja muut orgaaniset hapot), päästään jo lähelle nollaa. Lisäksi on otettava huomioon, että albumiini käyttäytyy kuten happo, koska sen nettovaraus on negatiivinen.
Elimistö tuottaa n.15,000 mmol ylläkuvattuja happoja/vrk, nämä täytyy erittää munuaisten kautta. Jos tämä prosessi jostain syystä häiriintyy, saadaan negatiivisten ionien ylimäärä ja ns. metabolinen asidoosi. Metabolinen asidoosi syntyy myös, jos jostain syystä menetetään kationeja (esim. ripuli). Jos menetetään negatiivisia ioneja (kloridi tai albumiini), saadaan metabolinen alkaloosi.
Vahvojen kationien ja anionien erotuksesta käytetään nimitystä SID (Strong Ion Difference) ja se lasketaan seuraavasti:
Nykyään verikaasuanalysaattorit mittaavat myös laktaatin joten se voitaisiin erottaa muista vahvoista anioneista omaksi tekijäksi. ABL-analysaattoreilta saadaan suoraan (ilman magnesiumia) laskettua SIDa (apparent)
Jos otetaan huomioon heikot hapot hiilihappo, albumiini ja fosfaatti, voidaan laskea SIDe (effective).
Jos lasketaan kaikkien positiivisten ja negatiivisten varausten pitoisuudet yhteen pitäisi saavuttaa elektroneutraalius ja SIDa - SIDe = 0. Jos plasmassa on anioneita, joita ei pystytä mittaamaan, tulee erotus positiiviseksi. Erotuksesta käytetään nimeä Strong Ion Gap (SIG):
Myös nimi NUI (Net Unmeasured Anions) on käytössä. SIG-arvo voi olla positiivinen monista syistä, esim. seuraavia anioneita ei kyetä mittaamaan suoraan: Sulfaatti, ketohapot (betahydroksivoihappo on poikkeus), sitraatti, pyruvaatti, asetaatti, glukonaatti jne.).
Kvantitatiivista verikaasuanalyysiä varten on olemassa Excel-laskentamalli.
Respiratorisen komponentin arviointi on suoraviivaista: Jos veren hiilidioksidiosapaine on suurentunut (esim. huono ventilaatio tai lisääntynyt tuotanto) on potilaalla respiratorinen asidoosi. Normaali pCO2 on n. 5.3 kPa (40 mmHg). Hyperventilaatiossa pCO2 on alentunut ja potilaalla on respiratorinen alkaloosi.
Bikarbonaattipitoisuus vaihtelee hiilidioksidiosapaineesta ja pH:sta riippuen. Hiilidioksidiosapaine voidaan laskennallisesti korjata arvoon 5.3 kPa jolloin voidaan laskea ns. standardibikarbonaatti, joka ei riipu hiilidioksidin osapaineesta. Amerikkalaisessa kirjallisuudessa käytetään usein mallia, jossa happoemästaseen metabolisen komponentin arvioinnissa keskitytään standardibikarbonaattipitoisuuden muutoksiin. Kuten edellä kuvattu analyysi osoittaa, ei pelkkään bikarbonaattipitoisuuteen tuijottamalla saada tietoa happoemästaseen häiriöiden kaikista tekijöistä.
Tanskalaiset ovat kehittäneet kokeelliseen titraukseen perustuvan mallin, jossa hiilidioksidiosapaineen suhteen vakioitu plasma (tai kokoveri) titrataan normaaliin pH-arvoon 7.4. Jos tarvitaan X mmol vahvaa happoa palauttamaan pH normaaliksi sanotaan, että potilaan emäsylimäärä (BE, Base Excess) on X mmol/l ja potilaalla on metabolinen alkaloosi. Jos emäsylimäärä on negatiivinen, on potilaalla metabolinen asidoosi.
Emäsylimäärästä esiintyy kaksi eri versiota, aktuaalinen (ABE) ja standardi (SBE). Menemättä yksityiskohtiin voidaan todeta, että ottaen huomioon laskennalliset epävarmuudet ei ole suurtakaan merkitystä, kumpaa käytetään. Emäsylimäärä SBE ja SID:n poikkeama normaalista ovat hyvin lähellä toisiaan sekä teoriassa että käytännössä.
Happoemästasapainon säätely voidaan jakaa kahteen toisistaan riippumattomaan mekanismiin:
Jos toinen mekanismi pettää, voi toinen kompensoida. Jos sekä SID ja pCO2 nousevat tai laskevat 5%, ei [H+] muutu. Plasman bikarbonaattipitoisuus muuttuu 5%.
Elimistön toiminta vaatii, että solunulkoisessa tilassa on enemmän Na-ioneja kuin solun sisällä. Vastaavasti kaliumioneja on suhteessa enemmän solujen sisällä. Tästä seuraa, että solunulkoinen tila on lähtökohtaisesti erittäin alkalinen (pH > 12). Näin emäksinen liuos ei olisi sopiva proteiinien toiminnalle. Tuottamalla sopivan määrän hiilidioksidia elimistö pystyy neutraloimaan vahvat emäkset ja tuottamaan paremmin elämälle sopivat olosuhteet. Säätelemällä hengitystiheyttä on mahdollista korjata nopeasti pienet happoemästasapainon poikkeamat.
Seuraavassa esitetään todellisia potilastuloksia ja niiden analyysit edellä kuvatuilla periaatteilla. Esimerkit on poimittu n. 3000 potilaan näytteistä, jotka on mitattu ABL825-analysaattorilla. Seuraavat keskimääräiset arvot (laskettu edellä mainitusta aineistosta) kannattaa muistaa tulosten tarkastelussa.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID |
|---|---|---|---|---|---|---|---|---|---|---|
| 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
SID lasketaan esimerkeissä kaavasta:
Myös natriumin ja kloridin erotus on otettu yhdeksi selittäväksi parametriksi. Sen avulla voi nopeasti todeta, onko kloridin pitoisuus poikkeava suhteessa natriumiin. Kloridin pitoisuus elimistössä ei ole samalla tavalla säädelty kuin muiden ionien, se seuraa normaalisti natriumin vaihtelua.
Esimerkkejä tulkitessa on otettava huomioon, ettei ole tietoa potilaiden albumiinipitoisuudesta. Matala albumiinipitoisuus vähentää SIDe:tä ja nostaa näin pH:ta.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.34 | 128 | 4.3 | 1.19 | 93 | 1.6 | 0 | 6.5 | 26 | 35 | 38 |
pH arvo on hieman alentunut eli potilaalla on lievä asidoosi. SID ei ole poikkeava ja vaikka natrium ja kloridi ovat molemmat alentuneet ei niiden erotus ole poikkeava. Hiilidioksidin osapaine on koholla joten potilaalla on lievä respiratorinen asidoosi.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.47 | 140 | 4.1 | 1.18 | 108 | 0.7 | 2 | 4.6 | 25 | 32 | 37 |
pH arvo on hieman kohonnut eli potilaalla on lievä alkaloosi. SID ei ole poikkeava ja natriumin ja kloridin erotus on normaali. Hiilidioksidin osapaine on alentunut joten potilaalla on lievä respiratorinen alkaloosi.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.25 | 139 | 5.2 | 1.31 | 114 | 0.9 | -7 | 5.9 | 19 | 25 | 31 |
Puhtaita hyperkloreemisia asidooseja tavataan harvoin (esim. renaalinen tubulaarinen asidoosi), mutta muiden häiriöiden yhteydessä korkea kloridipitoisuus on sairaalapotilailla yleistä. Syynä on yleensä puskuroimattoman NaCl-liuoksen anto i.v.
Yllä kuvatussa tapauksessa pH arvo on hieman alentunut eli potilaalla on lievä asidoosi. SID on alentunut ja selittyy natrium ja kloridin erotuksella, joka on -8 mmol/l verrattuna keskiarvoon. Myös alentunut ABE kertoo saman asian. Korkea kalium johtuu asidoosista kun vetyionit vaihdetaan kaliumioneihin munuaisissa.
Metaboliselle asidoosille on tyypillistä bikarbonaatin alentuminen mutta tässä tapauksessa sitä kompensoi kohonnut hiilidioksidin osapaine. Standardibikarbonaatti (ei vastattu) olisi enemmän poikkeava. Standardibikarbonaatti lasketaan niin, että korjataan hiilidioksidiosapaine laskennallisesti arvoon 5.3 kPa.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.51 | 137 | 3.6 | 1.10 | 89 | 1.1 | 11 | 5.7 | 34 | 48 | 51 |
Hypokloreemisen alkaloosin yleisin syy on kloridin menettäminen oksennuksissa. Bikarbonaatti ottaa tässä tapauksessa kloridin paikan negatiivisena ionina.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.18 | 137 | 3.8 | 1.19 | 106 | 7.1 | -13 | 5.6 | 15 | 31 | 28 |
Alentunut (-8 mmol/l) SID selittyy kohonneella laktaattipitoisuudella. Natriumin ja kloridin erotus on lähes normaali joten kloridi ei paljon lisää happamuutta. ABE -13 mmol/l viittaa siihen, että matala pH saattaa johtua lisäksi muiden anionien kuin kloridin tai laktaatin kohonneista pitoisuuksista.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.19 | 132 | 5.4 | 1.34 | 109 | 4.6 | -6 | 9.4 | 26 | 23 | 24 |
pCO2 on selvästi koholla. ABE on -6 mmol/l joka viittaa samanaikaseen metaboliseen asidoosiin. Jos olisi pyydetty pelkkä HE-Tase, ei tuloksista saataisi muuta informaatiota. Täysi verikaasuanalyysi paljastaa korkean laktaattipitoisuuden ja (suhteessa natriumiin) korkean kloridipitoisuuden. Korkea kaliumpitoisuus on seurausta asidoosista, joka aiheuttaa kaliumin kohonneen takaisinoton munuaisissa (kalium vaihdetaan vetyioniin). Tämä korjaantuu samalla kun pH normalisoituu.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.36 | 139 | 3.5 | 1.09 | 94 | 0.7 | 12 | 9.6 | 40 | 45 | 47 |
pH on normaalialueen alarajalla ja pCO2 on selvästi koholla. ABE on +12 mmol/l joka viittaa samanaikaseen metaboliseen alkaloosiin. Jos olisi pyydetty pelkkä HE-Tase, ei tuloksista saataisi muuta informaatiota. Täysi verikaasuanalyysi paljastaa (suhteessa natriumiin) matalan kloridipitoisuuden. ABE ja SID:n muutos ovat samansuuruisia eli muita kationeita ei ole vaikuttamassa. Pelkkä verikaasuanalyysi ei tässä tapauksessa paljasta häiriön ensisijaista syytä.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.53 | 141 | 3.4 | 1.03 | 108 | 0.9 | 8 | 4.8 | 31 | 33 | 36 |
Tämän potilaan korkealle pH:lle ei löydy selitystä edes täydellisestä verikaasuanalyysistä. pCO2 on lievästi alentunut mutta bikarbonaatti (negatiivinen ioni) on siitä huolimatta huomattavasti kohonnut. Jostain on tullut positiivisia ioneja mutta ne eivät näy analyysissä. Yksi selitys voisi olla esim. munuaisten vajaatoiminnassa esiintyvät orgaaniset amiinit (guanidomeripihkahappo ja metyyliguanidiini), joiden pitoisuudet nousevat munuaisten vajaatoiminnassa satakertaisiksi. Lisäksi matala albumiinipitoisuus saattaa vähentää negatiivisten ionien määrää ja voimistaa alkaloosia.
| pH | Na | K | Ca | Cl | Laktaat | ABE | pCO2 | HCO3 | Na-Cl | SID | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Normaali | 7.40 | 140 | 4.0 | 1.25 | 107 | 1 | 0 | 5.3 | 24 | 33 | 36 |
| Potilas | 7.21 | 137 | 4.1 | 1.18 | 107 | 1.5 | -20 | 2.2 | 7 | 30 | 32 |
Tämän potilaan matalalle pH:lle ei löydy selitystä edes täydellisestä verikaasuanalyysistä. pCO2 on voimakkaasti alentunut joten kyseessä on osittainen respiratorinen kompensaatio. Na-Cl -erotus, SID ja laktaattipitoisuus ovat lähes normaaleja, ABE sen sijaan osoittaa voimakasta metabolista asidoosia. Näytteessä on oltava negatiivisia ioneja, joita verikaasuanalyysi ei mittaa. Jos kysessä olisi esim. glykolimyrkytys, pitäisi laktaattipitoisuuden olla suurempi. Glykolista syntyy metabolian kautta glykoli- ja glyoksyylihappoa, jotka molemmat reagoivat ABL-analysaattorissa laktaatin tavoin. Vastasyntyneiden metabolisissa häiriötiloissa syntyy erilaisia orgaanisia happoja jotka aiheuttavat asidoosin mutta eivät näy tavanomaisissa analyyseissä. Todennäköisempi selitys on kuitenkin diabeettinen ketoasidoosi, joka olisi mahdollista todeta mittaamalla veren beetahydroksibutyraatti. ABL-verikaasuanalysaattorit mittaavat myös glukoosin joka tässä tapauksessa olisi voinut auttaa oikeaan diagnoosiin. Glukoositulos oli 18.3 mmol/l.
Yllä kuvatut yhdeksän tapausta ovat hieman ääriesimerkkejä, yleensä löydökset ovat erilaisten mekanismien summa. Tärkeintä on tunnistaa, mikä mekanismi on potilaan kliinisen kuvan perusteella todennäköisin ja käyttää verikaasuanalyysiä tunnistamaan happoemästasapainon muutoksen suunta ja suuruus. Tilaamalla täydellinen verikaasuanalyysi (VeKaasT) on mahdollista saada kvantitatiivista tietoa eri syistä.